Herpes-Enzephalitis mit Mini-Hirnen analysieren
Etwa 3,7 Milliarden Menschen — 67 Prozent von uns — tragen das Herpes-simplex-Virus-1 in ihren Nervenzellen. Dort überdauert es quasi schlafend, bis Stress oder eine Verletzung das Virus wecken. Wird es aktiviert, sind die Symptome meistens mild und beschränken sich auf Bläschen oder Entzündungen an den Lippen.
Wandert das Virus aber zu den Nervenzellen im Gehirn, kann es dort eine lebensbedrohliche Gehirnentzündung auslösen. Das passiert zwar sehr selten, dennoch gibt es etliche Betroffene: Etwa fünf bis 15 Prozent aller viraler Hirnentzündungen bei Kindern und Erwachsenen entstehen so. Ärztinnen und Ärzte verschreiben ihnen dann meist ein antivirales Mittel namens Acyclovir. Dennoch bleiben bei vielen Patient*innen langfristig Schäden zurück: Sie leiden unter schwerem Gedächtnisverlust, an Krampfanfällen und anderen kognitiven Problemen.
Eine Kombinationstherapie aus einem antiviralen und einem entzündungshemmenden Mittel könnte die Prognose der Patient*innen verbessern, legt eine neue Studie in „Nature Microbiology“ nahe. Forscher*innen vom Max Delbrück Center in Berlin haben diese Entdeckung mithilfe eines dreidimensionalen Gehirn-Modells gemacht, das sie aus Stammzellen produziert haben. Solche Modelle – Organoide – finden gerade ihren Weg aus der Grundlagen- in die klinische Forschung.
„In diesen Proto-Gehirnen kommunizieren Tausende Neuronen synchronisiert miteinander. So sind wichtige Experimente möglich, die noch vor ein paar Jahren gescheitert wären“, sagt Professor Nikolaus Rajewsky, der Direktor des Berliner Instituts für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB) und Letztautor der Studie.
Dr. Agnieszka Rybak-Wolf, die Leiterin der Organoid-Plattform am Max Delbrück Center und eine der Erstautor*innen, hat die Organoide herangezogen – bis es etwa 0,5 Zentimeter kleine weiße Kügelchen waren. „Hirn-Organoide sehen ein bisschen wie kleine Wolken aus Gewebe aus“, sagt sie.
Im Fall von Herpes-Infektionen näher an der Realität
Ohne Organoide kann man nur schwer analysieren, wie eine durch HSV-1 verursachte Gehirnentzündung verläuft. Das Virus infiziert nur Menschen – und an Proben aus dem Gehirn von Patient*innen zu kommen, ist nur in Ausnahmefällen möglich. Stattdessen haben Wissenschaftler*innen bisher die Krankheit mithilfe von Nervenzellen in der Petrischale untersucht. Oder sie nutzen Mäuse, die jedoch normalerweise gar keine Träger des Virus sind.
„Organoide sind im Fall von Herpes deutlich näher an der Wirklichkeit als alles, was uns bisher zur Verfügung stand“, sagt Dr. Emanuel Wyler, einer der Erstautor*innen. Der Systembiologe hat sich auf Viren spezialisiert und untersucht in der Arbeitsgruppe von Professor Markus Landthaler die molekularen Mechanismen im Laufe einer Herpes-Infektion.
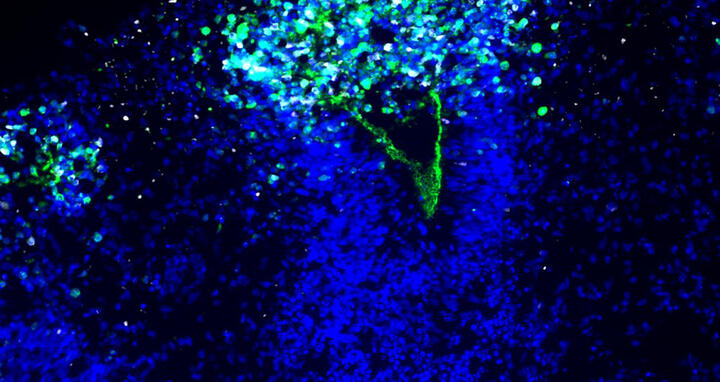
Das Bild zeigt, wie das Herpes-Virus (weiß) sich im Organoid ausbreitet und die Auskleidung eines Ventrikels, also das Neuroepithel, zerstört. Die Zellkerne sind blau zu sehen, das Neuroepithel ist grün angefärbt.
Die Wissenschaftler*innen haben die Organoide zunächst mit HSV-1 infiziert. Während das Virus wütete und die Mini-Hirne zerfielen, färbte das Team Neuronen und Neuroepithel an und machten das Schicksal der Zellen sichtbar. „Da sind wunderschöne Mikroskopie-Bilder entstanden. Sie machen sehr deutlich, was wirklich im Gewebe passiert“, sagt Wyler.
Mithilfe von Einzelzellanalysen konnte molekulare Signalwege identifiziert werden, die während einer Infektion eingeschaltet sind. „Der Ansatz zeigt ganz neutral – unabhängig von unseren Hypothesen – alle Signalwege und Gene, auf die es ankommt“, sagt Dr. Ivano Legnini. Der Systembiologe hat in Rajewskys Arbeitsgruppe geforscht und ist ebenfalls einer der Erstautor*innen. „Wir setzen auf die Systembiologie.“
Zum Vergleich ein gesundes Kontroll-Organoid.
Ein Signalweg, der während einer Entzündungsreaktion wichtig ist, war besonders aktiv: TNF-α. Behandelten die Forschenden die Organoide mit der Standardtherapie Acyclovir, vermehrte sich das Virus zwar nicht mehr. Das Gewebe nahm jedoch trotzdem Schaden. Die weitere Analyse zeigte, dass der Signalweg trotz Therapie eingeschaltet war.
Wenn die Abwehr Schaden verursacht
„Dieser Entzündungssignalweg ist wichtig für die natürlichen Abwehr gegen das Virus“, sagt Dr. Tancredi Massimo Pentimalli. Der Arzt macht gerade seinen PhD in Systembiologie in der Arbeitsgruppe von Rajewsky und ist ebenfalls einer der Erstautor*innen. „Aber wenn wir die Virusreplikation mit antiviralen Mitteln unterbinden, kann eine überschießende Entzündungsreaktion entstehen und stattdessen Schaden anrichten.“
Rybak-Wolf behandelte die Organoide schließlich mit einem antiviralen und einem entzündungshemmenden Mittel, das den TNF-α-Signalweg abschalten konnte. Diese Kombinationstherapie konnte die Mini-Hirne vor Schäden bewahren. „Es gibt also einen Signalweg im Gehirn, der während der Infektion aktiv ist – wenn wir ihn mit den beiden Wirkstoffen abschalten, wird das jeweilige Organoid nicht geschädigt“, sagt sie.
Die Wissenschaftler*innen hoffen, dass Ärzt*innen nun die Kombination aus Acyclovir und einem entzündungshemmenden Mittel als Therapieoption bei HSV-1-Enzaphalitis ausprobieren. „Ich hoffe, dass unsere klinischen Kolleg*innen die Wirksamkeit der neuen Kombinationstherapie in Studien mit Patient*innen mit Herpes-Enzephalitis evaluieren und letztlich unsere Erkenntnisse vom Labor in die Klinik bringen“, sagt Pentimalli.
gav
Weiterführende Informationen
Literatur
Agnieszka Rybak-Wolf, Emanuel Wyler, Tancredi Massimo Pentimalli, Ivano Legnini et al. (2023): „Modeling herpes simplex virus 1 infection in cerebral organoids reveals new potential therapeutic approaches for viral encephalitis“. Nature Microbiology, DOI: 10.1038/s41564-023-01405-y
Fotos zum Download
Das Bild zeigt, wie das Herpes-Virus (weiß) sich im Organoid ausbreitet und die Auskleidung eines Ventrikels, also das Neuroepithel, zerstört. Die Zellkerne sind blau zu sehen, das Neuroepithel ist grün angefärbt.
Foto: Dr. Agnieszka Rybak-Wolf, Max Delbrück Center
Zum Vergleich ein gesundes Kontroll-Organoid
Foto: Dr. Agnieszka Rybak-Wolf, Max Delbrück Center
Kontakte
Prof. Nikolaus Rajewsky
Direktor, Berliner Institut für Medizinische Systembiologie des Max Delbrück Center (MDC-BIMSB)
+49 30 9406-1585 (Büro Rajewsky)
rajewsky@mdc-berlin.de or veronika.jakobi@mdc-berlin.de (Büro Rajewsky)
Dr. Agnieszka Rybak-Wolf
Organoid-Plattform
Max Delbrück Center
Jana Schlütter
Redakteurin, Kommunikation
Max Delbrück Center
+49 (0) 30 9406 2121
jana.schluetter@mdc-berlin.de oder presse@mdc-berlin.de
- Max Delbrück Center
-
Das Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (Max Delbrück Center) gehört zu den international führenden biomedizinischen Forschungszentren. Nobelpreisträger Max Delbrück, geboren in Berlin, war ein Begründer der Molekularbiologie. An den Standorten in Berlin-Buch und Mitte analysieren Forscher*innen aus rund 70 Ländern das System Mensch – die Grundlagen des Lebens von seinen kleinsten Bausteinen bis zu organ-übergreifenden Mechanismen. Wenn man versteht, was das dynamische Gleichgewicht in der Zelle, einem Organ oder im ganzen Körper steuert oder stört, kann man Krankheiten vorbeugen, sie früh diagnostizieren und mit passgenauen Therapien stoppen. Die Erkenntnisse der Grundlagenforschung sollen rasch Patient*innen zugutekommen. Das Max Delbrück Center fördert daher Ausgründungen und kooperiert in Netzwerken. Besonders eng sind die Partnerschaften mit der Charité – Universitätsmedizin Berlin im gemeinsamen Experimental and Clinical Research Center (ECRC) und dem Berlin Institute of Health (BIH) in der Charité sowie dem Deutschen Zentrum für Herz-Kreislauf-Forschung (DZHK). Am Max Delbrück Center arbeiten 1800 Menschen. Finanziert wird das 1992 gegründete Max Delbrück Center zu 90 Prozent vom Bund und zu 10 Prozent vom Land Berlin.